Секрет прочности древнего раствора. Или откуда мастера знали про углекислый газ?

В статье Для чего в древности в кладочный раствор добавляли яйца и рисовый отвар? были показаны факты из истории и их современная интерпретация, говорящие про обоснованное применение белковой органики (яиц) в известковых растворах.
Проведенные опыты говорят, что этот прием ускорял твердение раствора, раствор набирал большую прочность. И что белок работал как катализатор роста кристаллов карбонатов кальция. Но в комментариях (особенно в моей группе в ВК) было много скептических мнений, которые выражали два момента – непонимание для чего это делали и откуда столько яиц для строительства.
Если со вторым суждением можно разобраться, предположив, что из-за этого многие храмы и церкви строили десятками лет. Скорость работ зависла, вероятно, и от поставок яиц с окрестных хозяйств. А вот с первым замечанием и в самом деле не все до конца понятно. Что это за каталитический процесс? Как белок может выступать в роли катализатора роста кристаллов соединений кальция? Каков механизм этого процесса? Как стыкуется органика и неорганика?
Ситуацию прояснил читатель, оставивший комментарий в статье и кратко описавший химический процесс. Суть в том, что при распаде белков, выделяется сероводород, амиак и углекислый газ. Серосодержащие аминокислоты: цистин, цистеин, метионин. При реакции с сероводородом из соединений кальция получается сульфид кальция: CaS. А при реакции сульфида с СО2 – карбонаты. Причем реакция, можно сказать, цепная.
Эти превращения можно отобразить так:
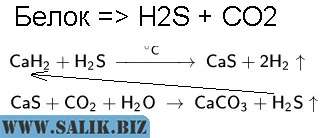
Гидрид кальция (CaH2) в начале реакций может быть и другим соединением кальция, например, просто известью (гидроксид кальция). При реакции с сероводородом получается сульфид и водород. А сульфид в реакции с углекислым газом и водой – превращается в карбонат кальция с выделением сероводорода, который опять соединяется с химически активными соединениями кальция. Карбонат кальция при увеличении концентрации в растворе вырастает в кристаллы – раствор набирает прочность.
Зачем вся эта сложность? Дело в том, что если углекислого газа внутри известкового раствора не будет, то раствор просто высохнет, не имея достаточной прочности. Реакция получения карбоната кальция произойдет лишь на поверхности раствора в кладке. А при размокании водой внутри – превратится в опять кашу (эффект мертвого гипса).
Карбонаты получаются и при реакции извести (гидроксида кальция) с углекислым газом:

И чем больше углекислого газа в объеме раствора – тем большую прочность он наберет.
Пример бутовой кладки в старом водопропуске заброшенной ветки ЖД-насыпи около Красноярска:




Раствор по прочности как гранит. Пробовал процарапать – не вышло. Сооружение строили тогда, когда в России был всего лишь один цементный завод. И весь раствор делали на основе извести. Но это 19-20 вв. Тогда уже были знания химии. Как быть с кладкой храмов в 12-15 вв.?
Откуда про эти химические процессы вяжущих растворов для строительства знали наши предки? Откуда они почерпнули информацию, что для набора прочности раствору нужен углекислый газ? Пусть без источника в белках – что он есть в атмосфере? Вывели методом проб и ошибок? Но, ведь, даже в наше время добавление яиц в раствор выглядит бредом! Или бред алхимии не такой и бред, если все ее приемы разобрать до химических соединений?





